2018年4月9日,清华大学生命科学学院、结构生物学高精尖创新中心李雪明课题组在《自然•微生物》(Nature Microbiology)杂志在线发表题为《肠毒性大肠杆菌中二型分泌系统定位蛋白与分泌通道蛋白复合体组装机制的结构观察》(Structural insight into the assembly of the type II secretion system pilotin–secretin complex from enterotoxigenic Escherichia coli)的研究论文,该工作通过冷冻电镜的研究手段首次揭示了细菌二型分泌系统中外膜定位蛋白和分泌通道蛋白复合物(Pilotin-Secretin,AspS-GspD)的近原子分辨率结构,结合相应的生化实验,阐述了该蛋白复合物的组装机理。
革兰氏阴性菌通过一系列不同类型的分泌系统向胞外或者其他细胞分泌各种底物,包括离子,小分子(如抗生素),大分子物质(如毒性蛋白,DNA)等,这些分泌出的底物大多都与人类健康息息相关。其中的二型分泌系统(T2SS)分泌的底物主要是折叠好的成熟蛋白质,通常是与疾病直接相关的毒性因子或效应蛋白,其中比较熟知的有霍乱毒素、肠毒素,以及外毒素A。李雪明课题组在2017年1月率先解析了细菌二型分泌系统外膜分泌通道蛋白复合物(Secretin GspD)的原子分辨率结构以及通道的半开放状态结构,结合相应的生化实验,阐述了底物通过二型分泌系统外膜分泌通道蛋白GspD的分泌机理。分泌通道蛋白GspD 作为细菌外膜蛋白,需要一种称为定位蛋白(Pilotin)的脂蛋白帮助其定位到外膜上,但由于GspD 结合定位蛋白的区域十分不保守,导致定位蛋白在物种中也很不保守,很多类似分泌通道(Secretin) 的定位蛋白是哪个至今仍不清楚。二型分泌系统全长定位蛋白-分泌通道蛋白(pilotin–secretin)复合物的结构至今未获得,组装方式和定位机理仍不清楚。
该工作首先通过荧光共定位实验,吸附洗脱实验以及冷冻电镜二维平均的方法证明了肠毒性大肠杆菌的YghG蛋白是GspD的定位蛋白(简称为AspS), 并且证明了定位蛋白与分泌通道蛋白能在体内形成稳定的复合物。通过单颗粒重构的方法解析了大肠杆菌来源的全长定位蛋白-分泌通道蛋白复合物3.2 Å分辨率的分子结构,揭示了该复合物中的两种蛋白AspS和GspD具有15:15的组装比例,与课题组之前报道的分泌通道蛋白十五重对称结构相吻合。有意思的是每一个定位蛋白AspS 都与两个相邻的分泌通道蛋白GspD 相互作用,这种相互作用包括一类强相互作用,和一类新发现的弱相互作用。通过参与强相互作用的一个基因保守的苯丙氨酸单突变,发现该苯丙氨酸对定位蛋白-分泌通道蛋白复合物的组装十分关键。
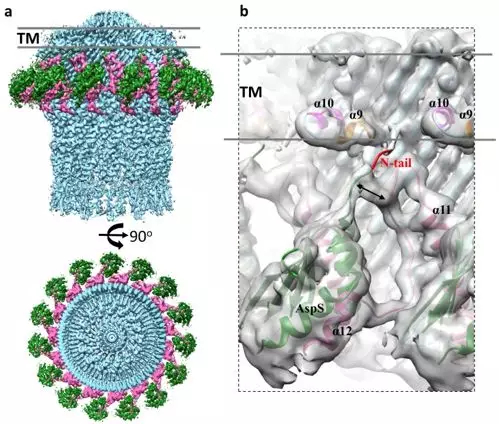
定位蛋白-分泌通道蛋白 (AspS-GspD)复合物冷冻电镜结构
清华大学生命科学学院、结构生物学高精尖创新中心李雪明研究员为本工作的通讯作者。清华大学PTN项目四年级博士生尹孟和生命学院四年级直博生严照峰为本文共同第一作者。该工作的冷冻电镜数据采集在国家蛋白质科学设施(北京)的清华大学冷冻电镜平台完成,数据处理在国家蛋白质科学设施(北京)清华大学高性能计算平台完成。该工作获得了生命科学联合中心、北京市结构生物学高精尖创新中心、国家自然科学基金委面上项目和科技部重点研发计划的经费支持。
论文链接: