电压门控离子通道是细胞表明控制离子运输的一类重要蛋白,包括钙离子、钾离子、钠离子等的运输。它们在众多的生理过程中都扮演着非常重要的角色,比如基因表达、神经信号传递、肌肉收缩、神经退行性疾病、心脏病、精神疾病等。电压门控离子通道蛋白是目前仅次于GPCR的第二大药物治疗靶点。
电压门控钙离子通道(voltage-gated calcium (Cav) channels, VGCC)蛋白家族包括10个成员,根据其序列上的差异,可分为三个亚家族,分别是Cav1.1-1.4、Cav2.1-2.3、Cav3.1-3.3。其中Cav1型通道又称为L型(long-lasting conductance),表示激活状态时间持久,激活需要较强的除极,由于结合dihydropyridine故也称为二氢吡啶受体。Cav2.1-2.3分别称为P、N、R型。Cav3家族为T型(transient conductance),表示激活状态时间短暂,失活快,激活也不需要较强的除极。
哺乳动物Cav离子通道的结构近年来取得了很多进展。2015年和2016年,颜宁组分别在Science和Nature报导了兔源Cav1.1的Cryo-EM原子分辨率结构【1,2】。今年5月,颜宁课题组再次在Cell杂志报导了兔源Cav1.1结合不同拮抗剂和激动剂的高分辨率结构(见BioArt报道:Cell | 颜宁组解析结合配体的哺乳动物电压门控钙离子通道结构)【3】,较为完整地提供了L型的Cav亚家族的分子机制,也为理解相关生理病理过程提供了重要的参考。而与L型相对应的T型电压门控Cav结构和分子机制尚不清楚。
2019年11月25日,普林斯顿大学、清华大学结构生物学高精尖创新中心国际学者颜宁研究组在Nature杂志上发表了题为Cryo-EM structures of apo and antagonist-bound human Cav3.1的研究论文。他们通过Cryo-EM技术,首次解析了人源Cav3家族Cav3.1的高分辨率的apo和结合拮抗剂的分子结构,分辨率分别为3.3 Å和3.1 Å。该工作为对比不同的Cav离子通道的相关分子机制提供了重要的参考,为药物靶点设计和药物筛选提供了参考模板。

尽管此前在表达电压门控通道蛋白经验丰富,但是颜宁组的研究人员还是在表达Cav3.1上遇到了不小的困难。与以往内源提取蛋白不同的是,他们本次实验的样品是通过重组表达获得。他们通过大量筛选实验,确定了小鼠中的一个剪接变体(I-II部分之间的linker缺失)——av3.1-Δ8b的表达量可显著上升。作者最终设计了相应的人源Cav3.1-Δ8b变体用于表达纯化,其中从全长蛋白(Uniprot ID:O43497-9)中删除了509-642位残基。
Z944是Cav3的一种高度选择性的阻滞剂,是II期临床试验中治疗癫痫和神经性疼痛的候选药物。它可阻断T型通道,它的IC50介于50-160 nM之间,与HVA Ca2+通道,Nav1和hERG相比【4-6】,具有260-2000倍的选择性。作者纯化到目的蛋白后,最终通过Cryo-EM技术,解决了人源Cav3.1-Δ8b的apo(图1a)和结合拮抗剂Z499的复合物结构(图2),总体分辨率分别为3.3 Å和3.1 Å。

图1. Cav3.1的整体结构(a)和Cav3.1与Cav1.1的结构对比(b)
结构上,Cav3.1与Cav1.1存在着比较大的差别。绝大部分在Cav1.1可以看到的胞外部分,比如α1-interacting domain (AID) helix,elongated S6II, the III-IV linker between S6III and VSDIV,以及整个蛋白的C端,在此次的Cav3.1结构中是看不到的(图1b)。
尽管如此,从与Z499结合的复合物结构(图2bcd)中还是看到了很多的结构变化,这些结构变化提供了Cav3.1对拮抗剂识别的分子基础。从结构中观察到的配体结合后的结构变化,体现了目标蛋白与先导化合物之间的复合物结构对于药物设计的至关重要性。这些工作结合之前的Cav复合物研究,为各种Cav通道疾病相关的药物筛选和疾病治疗方案奠定了框架。
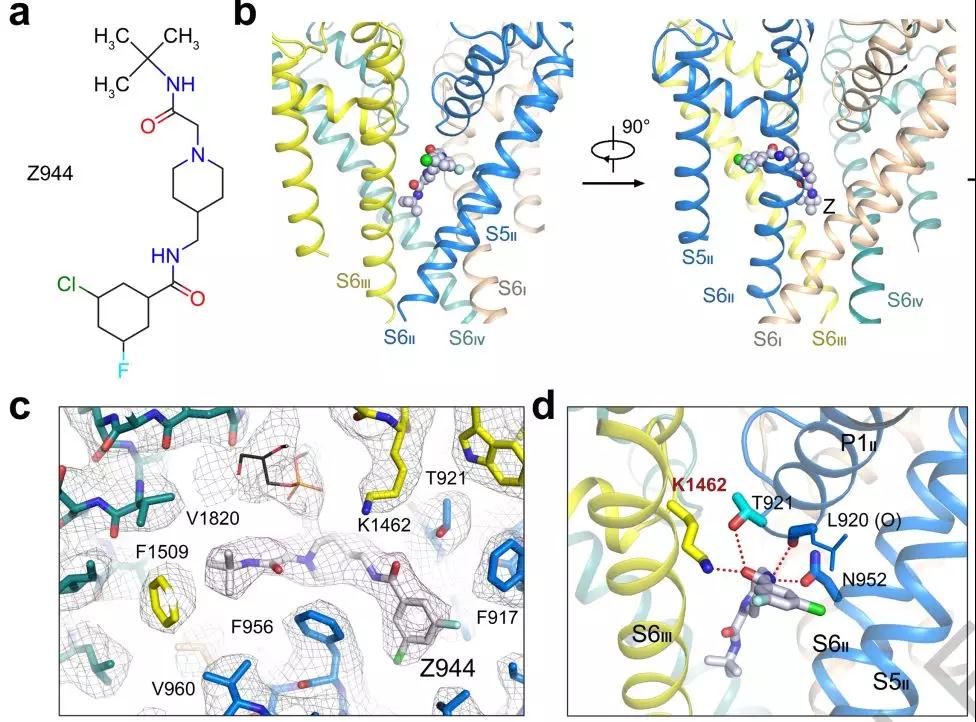
图2.Z499的结构式(a)和Cav3.1识别Z499的分子机制(b、c、d)
清华大学结构生物学高精尖创新中心国际学者颜宁教授为本文的通讯作者。西湖大学赵艳雨,清华大学黄高兴宇、吴秋蓉以及朝阳医院的吴坤为本文共同第一作者。清华大学高精尖创新中心潘孝敬博士、朝阳医院李瑞奇博士及清华大学冷冻电镜平台主管雷建林博士为本研究提供了帮助。北京市结构生物学高精尖创新中心(清华大学)、生命科学联合中心(清华大学)、生物膜与膜生物工程国家重点实验室、浙江省结构生物学重点实验室(西湖大学)以及科技部和基金委为该研究提供了经费支持。
原文链接
https://www.nature.com/articles/s41586-019-1801-3
参考文献
1. Wu, J. et al. Structure of the voltage-gated calcium channel Ca v 1.1 at 3.6 Å resolution. Nature 537, 191 (2016).
2. Wu, J. et al. Structure of the voltage-gated calcium channel Cav1. 1 complex. Science 350, aad2395 (2015).
3. Zhao, Y. et al. Molecular Basis for Ligand Modulation of a Mammalian Voltage-Gated Ca2+Channel. Cell177, 1495-1506. e1412 (2019).
4. Casillas-Espinosa, P. M. et al. Z944, a novel selective T-type calcium channel antagonist delays the progression of seizures in the amygdala kindling model. PLoS One 10, e0130012 (2015).
5. Dolphin, A. C. Voltage‐gated calcium channels and their auxiliary subunits: physiology and pathophysiology and pharmacology. The Journal of physiology 594, 5369-5390 (2016).
6. Tringham, E. et al. T-type calcium channel blockers that attenuate thalamic burst firing and suppress absence seizures. Science translational medicine 4, 121ra119-121ra119 (2012).