7月28日,高精尖中心成员李海涛实验室在《分子细胞》(Molecular Cell)在线发表题为 “ZMYND8 Reads the Dual Histone Mark H3K4me1-H3K14ac to Antagonize the Expression of Metastasis-Linked Genes” (ZMYND8通过识别组蛋白H3第4位赖氨酸单甲基化(H3K4me1)和第14位赖氨酸乙酰化(H3K14ac)双重修饰拮抗肿瘤迁移相关基因的表达)的合作论文。研究揭示ZMYND8(又名RACK7)通过其PHD锌指与溴域(PHD-Bromo)串联结构域协同识别组蛋白修饰,并与组蛋白H3K4去甲基化酶JARID1D(又名KDM5D和SMCY)直接互作,作为转录共抑制因子调控前列腺癌迁移相关基因表达。
组蛋白翻译后修饰是表观遗传调控的重要方式之一,参与基因转录、染色质分离、DNA修复等众多细胞过程。“阅读器”(reader)蛋白可通过识别特定组蛋白修饰调控基因表达,其功能紊乱与肿瘤等疾病发生密切相关。因此“阅读器”蛋白常常被作为重要靶点指导药物发现。例如靶向组蛋白乙酰化阅读器-溴域蛋白家族BET的小分子抑制剂目前已在包括乳腺癌、白血病等临床试验中显示出较好的疗效。
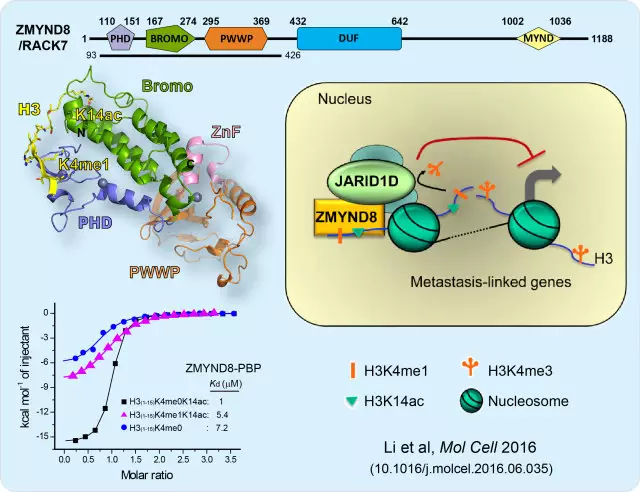
ZMYND8组合型识别组蛋白H3双修饰抑制肿瘤转移相关基因表达
本研究首先以JARID1D为诱饵,通过体内免疫共沉淀鉴定出一种包含ZMYND8、JARID1D、Mga等组分的染色质调控复合物。体外pull-down和ChIP-seq等试验表明ZMYND8与JARID1D有直接相互作用,且二者的染色质定位及靶基因具有高度重合性,均在在转录起始区附近存在富集。受二者共同调控的基因参与多种细胞过程,包括信号传导,转录,细胞粘附以及细胞连接等。敲低ZMYND8可以促进前列腺癌细胞的侵袭,RNA-seq分析表明ZMYND8敲低会导致肿瘤迁移相关基因表达水平上调,其中约三分之一的基因与JARID1D敲低上调基因重合。进一步的多肽结合实验发现ZMYND8通过其串联PHD-Bromo结构域协同识别组蛋白双重修饰“H3K4me0-H3K14ac”(Kd ≈ 1 μM)或者“H3K4me1-H3K14ac”(Kd ≈ 5.4 μM)来定位至肿瘤迁移相关基因处,与JARID1D相互依赖,引起H3K4me3/2水平降低,进而协同抑制靶基因的表达水平。我们解析了ZMYND8串联PHD-Bromo-PWWP结构域复合物结构,并结合同源模建和生化结合实验获得了ZMYND8 PHD-Bromo串联结构域与H3“K4me0/1-H3K14ac”复合物结构模型。结构研究表明,ZMYND8延伸的氨基端对于H3K4me0/1的识别至关重要,而Bromo与PHD锌指之间存在紧密的相互作用,对于稳定整体结构与结合口袋和多肽识别至关重要。我们也根据结构找到了一个F109D突变体能够显著增强与组蛋白多肽的识别,该突变体被证明在体内显示出了比野生型ZMYND8更明显的抑制效果。综上,该研究表明ZMYND8可以通过对组蛋白双重修饰的识别靶向肿瘤迁移相关基因转录调控区,并通过招募组蛋白去甲基化酶JARID1D维持一个转录抑制的染色质状态,进而协同抑制肿瘤细胞转移。
值得一提的是,今年4月复旦大学蓝斐课题组与哈佛大学施扬课题组在《细胞》(Cell)杂志合作发表研究论文,发现ZMYND8与组蛋白去甲基化酶KDM5C协同作用通过控制活化增强子(enhancer)处H3K4me1与H3K4me3的动态平衡,扮演活化增强子“刹车”的角色,以抑制增强子过度激活,丧失这种监管机制将可能促成肿瘤发生,这项研究首次揭示出增强子可以受到负调控,ZMYND8对KDM5C招募至增强子处起重要作用。由于组蛋白H3“K4me0/1-K14ac” 修饰恰恰是增强子区染色质的标志性修饰,本工作所揭示的ZMYND8对“K4me0/1-K14ac”双修饰的组合型识别(combinatorial readout)也及时地解释了ZMYND8-KDM5C被招募并稳定在增强子区染色质的分子机制,为相关疾病发生的作用机制提控了分子基础。
清华大学医学院李海涛教授、美国MD安德森癌症中心Min Gyu Lee教授,以及贝勒医学院的李蔚教授为本论文共同通讯作者;李海涛实验室高精尖中心“卓越学者”李元元博士、MD安德森癌症中心李娜博士,以及美国卫理公会医院研究所的吕杰博士为共同第一作者。李海涛教授实验室主导完成了多肽结合和结构生物学工作,实验室成员郑向东博士作为第二作者参予本项研究。本项研究工作是继2014年4月,李海涛实验室与美国MD安德森癌症中心石晓冰实验室在《自然》(Nature)杂志发表合作论文,发现并阐明抑癌因子ZMYND11识别组蛋白H3.3变体甲基化新机制后,在ZMYND家族成员结构与功能研究上的又一突破。本工作得到科技部国家重点研究计划重点专项、国家自然科学基金委、中国博士后科学基金、北京结构生物学高精尖创新中心、清华-北大生命科学联合中心、生物治疗协同创新中心等资助。仪器设备使用得到“凤凰工程”蛋白质基础设施(清华)支持。衍射数据收集得到上海同步辐射光源BL17U线站的大力支持与协助。