北京时间2018年6月29日,颜宁研究组在《科学》(Science)杂志在线发表了题为《人源Patched1蛋白识别Sonic Hedgehog的结构基础》(Structural basis for the recognition of Sonic Hedgehog by human Patched1)的研究长文,解析了人源细胞表面受体蛋白Patched1(Ptch1)及其与配体蛋白Sonic Hedgehog (ShhN)复合物的冷冻电镜结构,揭示了Ptch1蛋白与ShhN的识别机理。基于结构观察进行的后续生化和结构研究发现并验证了Ptch1与ShhN相互作用对于固醇类分子的依赖性,从而为阐明Hedgehog信号通路的激活机理提供了重要线索。
Hedgehog这一经典的细胞信号通路控制胚胎发育及组织再生。分泌到胞外的配体蛋白Hedgehog与靶细胞表面的受体蛋白Patched的结合引发该通路的激活。Patched蛋白的下游分子是G蛋白偶联受体蛋白Smoothened。在Hedgehog缺失的情况下,Patched通过未知的方式间接抑制Smoothened;而Hedgehog与Patched的结合则解除该抑制,从而激活Smoothened及其下游通路,诱导与发育相关蛋白的表达。由于该通路的重要作用,其异常与多种疾病密切相关。抑制Hedgehog通路会导致婴儿的先天畸形,而其异常激活可能会诱发以基底细胞癌和成神经管细胞瘤为代表的几种癌症。尽管这条细胞通路已经被系统研究了30多年,Hedgehog和Smoothened这两个蛋白的多个晶体结构也陆续被解析,但是Patched如何抑制Smoothened以及Hedgehog解除该抑制的分子机理尚不清楚,Patched的三维结构也未知。
序列分析显示Patched具有两个大的胞外结构域和12次跨膜螺旋(TM),其中TM2-6构成了一个保守的固醇感知结构域(sterol-sensing domain,SSD)。目前已知数个含有SSD的蛋白,它们与胆固醇及其衍生分子的运输、代谢及调控密切相关,但是SSD识别固醇类分子的机理一直未知。颜宁研究组一直致力于揭示细胞内胆固醇的代谢及调控机理,尤其对SSD感知胆固醇的分子基础感兴趣。2016年,她们组报道了第一个含有SSD蛋白的结构,即NPC1的电镜结构,首次呈现了该结构域的折叠模式 (Gong et al., Cell, 2016),然而因为未能获得与胆固醇的复合物结构,所以一直无法解释胆固醇与SSD的相互作用基础。
在最新的研究中,颜宁研究组主要报道以下成果:
1. Ptch1蛋白分别处于ShhN结合与未结合状态下的两个结构(图1),分辨率分别为3.9 Å和3.6 Å。结构对比显示了ShhN结合前后Ptch1的跨膜区基本未变,但胞外结构域发生构象变化;
2. 出乎意料的是,在这两个结构中均在SSD和胞外结构域中各发现一个蛋白纯化中添加的胆固醇衍生物CHS(胆固醇琥珀酸单脂)分子;
3. 为了研究固醇类分子对于Ptch1的功能影响,该研究组在两个结合位点中引入了突变来破坏其与固醇类分子的结合。意外的是,这些并不位于ShhN结合表面的突变减弱了Ptch1与ShhN的相互作用。她们进一步发现添加CHS有效促进野生型Ptch1与ShhN之间的相互作用,但对这些突变体无效;
4. 在生化分析基础上,她们解析了其中一个固醇结合突变体Ptch1-3M的电镜结构(4.1 Å),证明这些突变确实破坏了Ptch1与固醇类分子的相互作用。Ptch1包括 SSD在内各个结构域在有无CHS的情况下产生了明显的构象变化,从而首次通过结构揭示了SSD感应胆固醇的分子基础,并且为Ptch1和ShhN相互作用的固醇依赖性提供了结构解释;
5. 这一系列结构生物学与生化分析使得作者们倾向于支持Ptch1是胆固醇转运蛋白(transporter)的假说。根据该假说,Smoothened可以被胆固醇激活,而Ptch1蛋白或者通过从膜上向外转运胆固醇来限制Smoothened获得胆固醇的能力,或者从外部向膜上转运胆固醇类似分子来抑制Smoothened。不论哪种模式,Ptch1作为转运蛋白需要经过构象变化才能完成对胆固醇或者其衍生物的转运,而Hedgehog的结合使得Ptch1无法进行构象变化,从而切断了这个过程,使得Smoothened可以激活。
最后,作者们指出这个研究对于极其复杂的Hedgehog通路只是冰山一角,还有很多问题需要解决。比如此前的研究及作者在纯化蛋白的过程中都观察到了Ptch1的寡聚化,但是该研究只获得了其单体的结构;另外,Patched和Smoothened都是在细胞纤毛上发挥作用,这个复杂的细胞生物学现象有待探索。尽管如此,该研究把对Hedgehog信号通路的理解推进了一大步,并且为研究其他含有SSD的蛋白提供了结构范本。
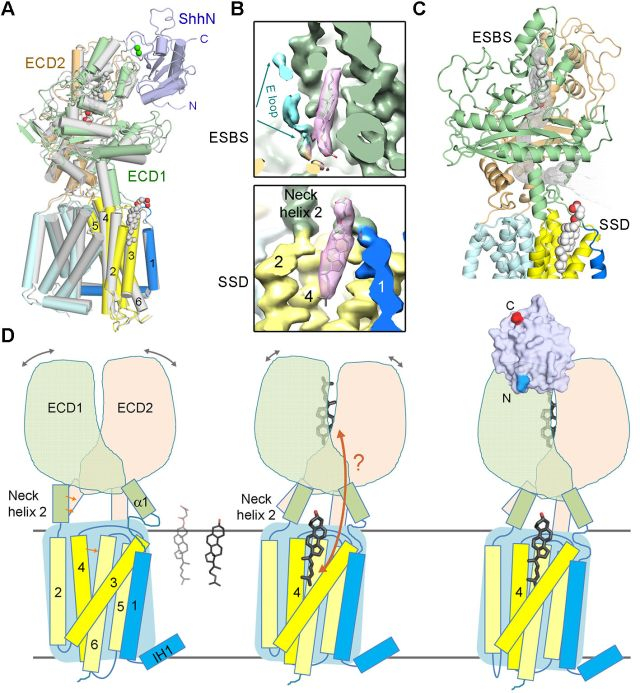
图1. 人源Patched1蛋白及其及其配体Sonic Hedgehog的复合体结构
原清华大学生命学院、结构生物学高精尖创新中心颜宁为通讯作者。原结构生物学高精尖创新中心卓越学者龚欣(医学院博士后)、原生命学院博士生钱洪武以及医学院在读博士生曹平平为本文的共同第一作者,CLS博士生赵馨与医学院副研究员周强也参与了该研究。尽管颜宁于2017年11月入职普林斯顿大学,但该工作的主体是在此之前完成,按照国际惯例,第一作者和通讯作者单位依旧为清华大学。至此,颜宁在清华大学十年间以通讯作者(含共同通讯作者)身份在Nature、Science、Cell发表的科研论文达到20篇。所有冷冻电镜数据都是在国家蛋白质科学中心(北京)清华大学冷冻电镜平台收集,雷建林博士指导了数据收集。本研究获得了清华大学冷冻电镜平台工作人员李小梅和李晓敏的大力支持。清华大学高性能计算平台分别为本研究的数据处理提供了支持。北京市结构生物学高精尖创新中心、生命科学联合中心(清华大学)、膜生物学国家重点实验室、科技部、基金委为本研究提供了经费支持。颜宁入职普林斯顿大学后受到Shirley Tilghman 讲席教授的专项经费支持。
原文链接:
http://science.sciencemag.org/content/early/2018/06/27/science.aas8935
相关链接:
https://www.cell.com/cell/fulltext/S0092-8674(16)30570-0