2018年11月7日,清华大学医学院、结构生物学高精尖创新中心Brian K. Kobilka教授研究组在美国科学院院刊(PNAS)杂志在线发表题为“Structure-guided development of selective M3 muscarinic acetylcholine receptor antagonists”的研究论文,报道了基于结构设计对毒蕈碱乙酰胆碱M3受体有选择性的拮抗剂的工作,该成果对G蛋白偶联受体选择性药物的研发具有指导意义。
G蛋白偶联受体(GPCR)家族是人体内最大的受体膜蛋白家族,包含约800个家族成员,能够感知光、气味分子、激素等信号分子,并将信号传递到细胞内,调节生理功能。人体中,GPCR涉及的生理活动包括视觉、味觉、心跳、呼吸、消化及腺体分泌等,同时,GPCRs 也是非常重要的药物靶点,全球治疗药物市场中大约有1/3的药物分子靶向GPCRs。
毒蕈碱乙酰胆碱受体是人体GPCRs家族中非常重要的成员,受神经递质乙酰胆碱激活,调节呼吸,心跳,腺体分泌以及泌尿系统等生理功能。毒蕈碱乙酰胆碱受体家族包含 M1,M2,M3,M4和M5等5个成员。这5种M受体分别具有不同的生理功能,且分布非常广泛。其中,M3受体主要分布于血管以及肺部呼吸系统中的平滑肌。 被乙酰胆碱激活的M3受体可以活化下游Gq蛋白,介导细胞内钙离子水平上升,导致平滑肌收缩。
由于其在体内重要的生理功能,M3受体一直是重要的药物靶点。目前已经有多种上市药物靶向M3受体,例如阿托品、噻托溴铵等。但是这些药物对其他亚型M受体也具有较高亲和力,存在脱靶产生副作用的风险。例如抗胆碱支气管扩张药——噻托溴铵(tiotropium),主要作用于肺支气管平滑肌中M3受体,能长时间阻滞乙酰胆碱介导的支气管平滑肌收缩,扩张支气管改善肺功能,临床上主要用于慢性阻塞性肺部疾病的维持治疗。虽然喷雾式的用药方式可以减少噻托溴铵对心脏M2受体的作用,但是它可能作用于肺部M2受体,引起某些副作用。因此,设计研究对某一亚型M受体有选择性的配体,具有重要的临床意义。事实上,很多重要的G蛋白偶联受体在人体内都具有多个亚型,这些亚型彼此之间非常相似,但是介导不同的生理功能。设计具有亚型选择性的GPCR配体是未来GPCR药物研发的重点。
Brian K. Kobilka教授在斯坦福大学的研究组在2012年解析了M2受体结合拮抗剂QNB和M3受体结合噻托溴铵(tiotropium)的晶体结构(Haga et al., 2012; Kruse et al., 2012)。结构比对显示M2受体和M3受体的配体结合口袋非常保守,只存在一个氨基酸残基的差异(M2/Phe181和M3/Leu225)。针对这一个氨基酸的差异,Brian K. Kobilka研究组与德国Peter Gmeiner研究组、加州大学旧金山分校的Brian K. Shoichet合作,利用化学合成和分子对接(molecule docking)的方法,设计对M3 受体具有选择性的拮抗剂小分子。

Peter Gmeiner研究组基于M受体拮抗剂QNB的分子骨架进行的改造从而筛选到选择性配体化合物6b 。QNB分子具有 两个六元环:A环和B环。 B环面向M2受体上的Phe181(即M3受体上的Leu225)。研究初期Peter Gmeiner研究组往B环上添加基团,试图造成与Phe181冲突,但是获得的小分子并不具有对M3受体的选择性。Brian Schoichet研究组通过分子模拟发现,B环可以主动摆开,避开与Phe181的冲突。Peter Gmeiner研究组对A环的位置进行了改造,将其直接连在B环上以限制B环的摆动,同时添加了一个具有电负性的氟原子在B环上,使之能与M2受体上的Phe181冲突,而能与M3受体上的Leu225兼容,从而获得对M3受体有选择性的配体。基于这个策略设计出的配体化合物6b 在体外实验中 对M3 受体的亲和力比M2受体高106倍,而体内实验选择性约有1000倍。
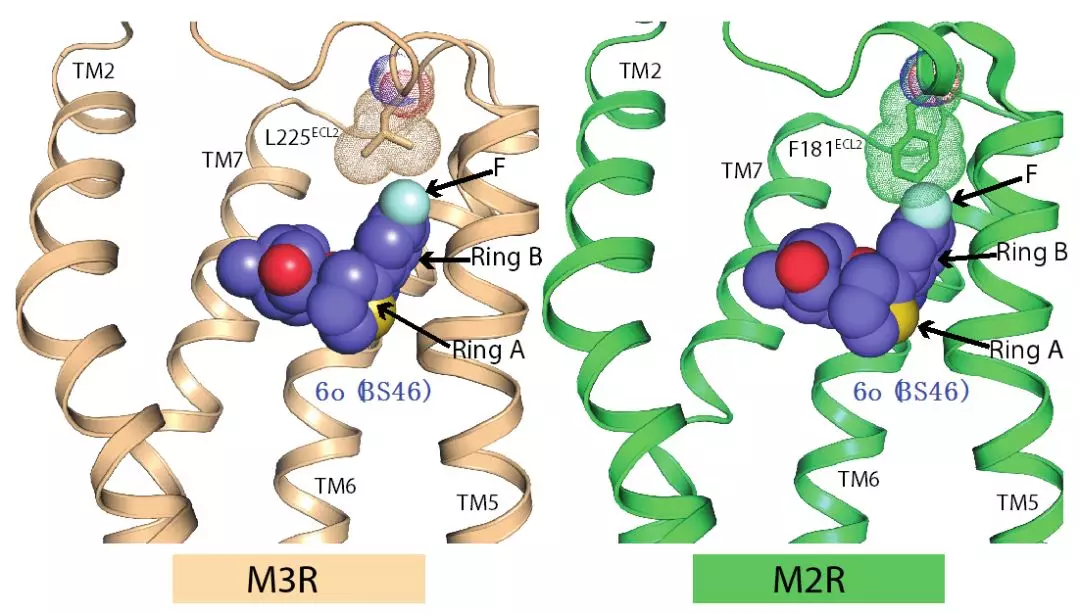
Brian K. Kobilka研究组试图解析M3受体与化合物6b 的复合物,以验证其结合方式。研究利用了一个毒蕈碱乙酰胆碱M3受体和改造的T4溶菌酶的融合蛋白(M3_mT4L)与化合物6b 共结晶,但是并没有获得晶体。除了化合物6b 之外,研究过程中还测试了其它多种相似的化合物,均没有获得晶体。其主要原因是这些化合物对M3受体有很高的解离速率,难以将受体稳定在均一构象,不利于晶体形成。之后Kobilka研究组基于噻托溴铵的分子式对化合物6b进行了优化设计,Peter Gmeiner研究组合成了新的选择性配体化合物6o (BS46)。化合物6o (BS46)对M3受体有很高的亲和力和选择性,同时解离速率很慢,有利于结晶。Brian K. Kobilka研究组解析了M3_mT4L与化合物6o (BS46)复合物3.1埃的晶体结构。其晶体数据清楚的显示了化合物6o (BS46)的结合位点,化合物6o (BS46)分子B环上氟原子指向M3受体第二个胞外柔性区的亮氨酸残基Leu225;在M2受体中该位置是一个苯丙氨酸残基Phe181,在搭建的M2受体结合化合物6o (BS46) 的模型中,Phe181明显和化合物6o (BS46) 的氟原子存在冲突。化合物6o (BS46) 在M3受体中的结合方式和用分子对接预测的化合物6o (BS46) 的位置几乎相同,而分子动态模拟(molecule dynamic stimulation)和突变后生化实验结果也表明该氨基酸(M3受体上的Leu225和M2受体上的Phe181)的差异造成了化合物6b 和化合物6o (BS46)对M3有选择性。
本工作是清华大学医学院、结构生物学高精尖创新中心、斯坦福大学医学院分子与细胞生理学系Brian K. Kobilka教授与德国弗里德里希-亚历山大 埃尔朗根-纽伦堡大学化学与药理学系Peter Gmeiner教授、加拿大女王大学医学院生物医学与分子科学系John T. Fisher教授、加州大学旧金山分校药物化学系Brian K. Shoichet教授及加州大学圣迭戈分校药理学系 Roger K. Sunahara教授共同合作的成果。其中Brian K. Kobilka教授实验室负责结构生物学工作、Peter Gmeiner教授实验室负责化学合成及分子动态模拟工作、Brian K. Shoichet教授实验室负责分子对接设计工作、Roger K. Sunahara教授实验室负责生化实验工作、John T. Fisher教授实验室负责小鼠生理实验。Brian K. Kobilka教授、Peter Gmeiner教授、Brian K. Shoichet教授以及清华大学医学院的助理研究员刘翔宇博士为本文共同通讯作者。清华大学生命学院及生命科学中心博士生刘洪涛、埃尔朗根-纽伦堡大学Josefa Hofmann博士和加州大学旧金山分校Inbar Fish博士为本文共同第一作者。本课题得到北京市结构生物学高精尖创新中心的资助。衍射数据收集得到日本SPing-8同步辐射光源的支持和协助。
1. Haga, K., Kruse, A.C., Asada, H., Yurugi-Kobayashi, T., Shiroishi, M., Zhang, C., Weis, W.I., Okada, T., Kobilka, B.K., Haga, T., et al. (2012). Structure of the human M2 muscarinic acetylcholine receptor bound to an antagonist. Nature 482, 547-551.