当地时间2019年2月14日,颜宁研究组在《科学》(Science)背靠背在线发表了题目分别为《μ-芋螺毒素阻断人源电压门控钠离子通道Nav1.2的分子机理》(Molecular basis for pore blockade of human Na+ channel Nav1.2 by the μ-conotoxin KIIIA)和《人源电压门控钠离子通道Nav1.7与辅助亚基和动物毒素复合物的结构》(Structures of human Nav1.7 channel in complex with auxiliary subunits and animal toxins)的两篇研究长文,分别解析了人源电压门控钠离子通道(以下简称钠通道)Nav1.2与其特异性阻断毒素μ-芋螺毒素KIIIA复合物和人源钠通道Nav1.7与其特异性调节毒素ProTx-II或Huwentoxin-IV复合物的冷冻电镜结构,分辨率分别为3.0和3.2 埃(1埃=0.1纳米),为深入理解钠通道工作机理、疾病突变致病机理和特异性毒素与其相互作用机理提供了分子基础,同时为针对钠通道的多肽类药物研发提供了可靠模板。
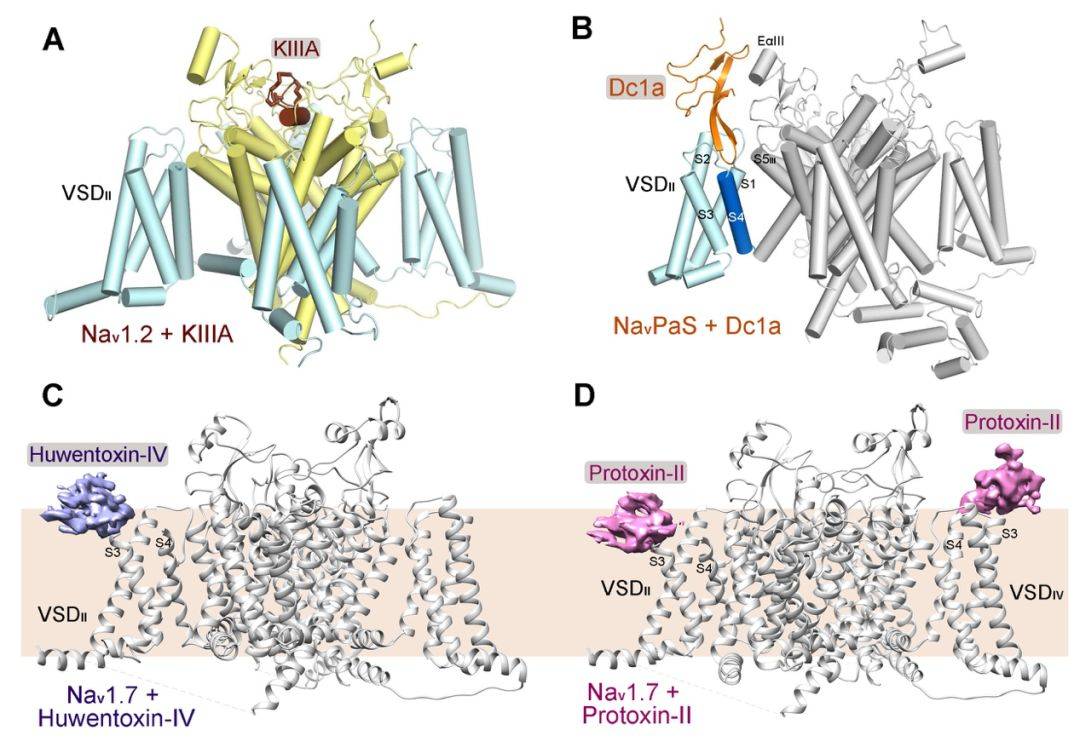
图.钠通道和毒素相互作用的不同模式
(A)Nav1.2与特异性毒素KIIIA的复合物结构;(B)NavPaS与Dc1a的复合物结构;(C)Nav1.7与特异性毒素Huwentoxin-IV的复合物结构;(D)Nav1.7与特异性毒素ProTx-II的复合物结构。
原清华大学生命科学学院、结构生物学高精尖创新中心颜宁教授是两篇研究论文的通讯作者。
Nav1.2文章:清华大学医学院博士后、结构生物学高精尖创新中心卓越学者潘孝敬,生命科学联合中心博士生李张强、黄高兴宇,以及生命科学学院二年级博士生黄晓爽为共同第一作者。清华大学刘磊实验室进行了毒素的合成工作。
Nav1.7文章:清华大学医学院博士后、结构生物学高精尖创新中心卓越学者申怀宗和生命科学学院二年级博士生刘栋梁为共同第一作者,毕业于清华大学医学院、现就职于首都师范大学附属北京朝阳医院心脑肺复苏北京市重点实验室的吴坤博士进行了Nav1.7相关的电生理分析。
国家蛋白质科学中心(北京)清华大学冷冻电镜平台和清华大学高性能计算平台分别为该研究的数据收集和数据处理提供了支持,清华大学冷冻电镜平台的雷建林博士对数据收集进行了指导,并获得工作人员李晓敏博士的技术辅助。北京市结构生物学高精尖创新中心(清华)、生命科学联合中心(清华大学)、生物膜与膜生物工程国家重点实验室、科技部和基金委为该研究提供了经费支持。颜宁教授自2017年秋季入职普林斯顿大学分子生物学系后受到Shirley M. Tilghman讲席教授专项启动经费的支持。
论文链接
Nav1.2 | http://science.sciencemag.org/content/early/2019/02/13/science.aaw2999?rss=1
Nav1.7 | http://science.sciencemag.org/content/early/2019/02/13/science.aaw2493?rss=1
相关论文链接
1. X. Zhang et al., Crystal structure of an orthologue of the NaChBac voltage-gated sodium channel. Nature 486, 130-134 (2012).
2. H. Shen et al., Structure of a eukaryotic voltage-gated sodium channel at near-atomic resolution. Science 355, (2017).
3. Z. Yan et al., Structure of the Nav1.4-beta1 Complex from Electric Eel. Cell 170, 470-482 e411 (2017).
4. H. Shen et al., Structural basis for the modulation of voltage-gated sodium channels by animal toxins. Science, (2018).
5. X. Pan et al., Structure of the human voltage-gated sodium channel Nav1.4 in complex with beta1. Science, (2018).