核小体是真核生物染色质的基本单元。经典的核小体由147 bp DNA缠绕组蛋白八聚体形成,其中组蛋白八聚体由两拷贝H2A-H2B二聚体和一拷贝(H3-H4)2四聚体组成。染色质结构高度动态可塑,核小体在复制,转录,DNA损伤修复等过程中经历拆分和重新组装,从而产生不同的中间态,如DNA解缠绕(DNA unwrapping),六聚核小体(hexasome)和四聚核小体(tetrasome)。这些中间态统称为亚核小体(subnucleosome),其保护的DNA片段(90-120 bp)显著短于完整核小体。虽然MNase-seq等基因组学技术检测到这些较短的受保护DNA片段,但由于现有技术无法区分亚核小体与多转录因子结合,加之酶切偏好性的干扰,使得亚核小体是否作为稳定功能单元存在于细胞内、其具体结构形式及生物学功能等核心问题仍悬而未决,成为探索染色质动态调控机制中富有挑战性的前沿领域之一。
生命科学学院/北京生物结构前沿研究中心陈柱成团队发现人源染色质重塑蛋白SMARCAD1对亚核小体的偏好性,并与郗乔然团队合作验证了SMARCAD1这一功能对小鼠胚胎干细胞干性维持的重要作用。相关工作发表在6月4日《自然》(Nature)上,题目是“人源染色质重塑蛋白SMARCAD1的亚核小体偏好性”(Subnucleosome preference of human chromatin remodeler SMARCAD1)。
SMARCAD1是一种非经典的染色质重塑蛋白,对DNA损伤修复以及胚胎干细胞的异染色质维持起重要作用。研究人员通过多种染色质重塑活性检测方法,意外发现SMARCAD1对亚核小体有显著的活性,而对经典核小体的活性微弱(图1a)。为揭示这一独特偏好性的机制,研究者通过冷冻电镜单颗粒技术解析了SMARCAD1结合六聚核小体的复合物结构(图1b)。与经典的结合方式不同,SMARCAD1马达结构域转向六聚核小体中因DNA解缠绕留下的开放区域。电镜结构揭示了SMARCAD1内部的几个关键构造特征。其中,马达内部插入有一个独特的组蛋白结合结构域(HBD,图1c),HBD与H4的相互作用对SMARCAD1的染色质重塑活性至关重要;SMARCAD1的C-端螺旋(CTH,图1d)向外延申并顺势结合到NPD上,从而把两个核心的马达结构域连接起来,这对偶联ATP水解和DNA滑移必不可少。在小鼠胚胎干细胞中,研究者通过敲低、回补Smarcad1基因证实HBD, CTH等关键元素对Smarcad1发挥干细胞多能性维持作用不可或缺(图1e)。
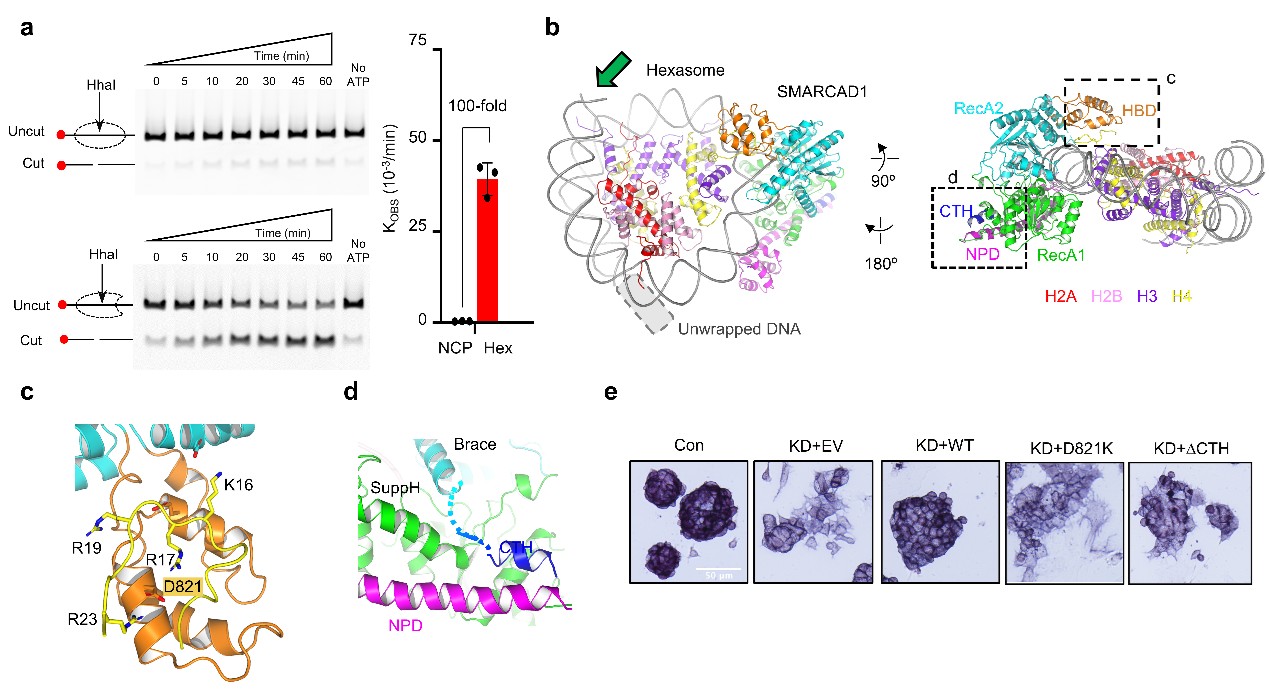
图1 SMARCAD1的亚核小体偏好性及其结构基础。(a) SMARCAD1染色质重塑活性表征。酶切位点暴露实验,使用经典核小体(上行)和亚核小体(下行)作为底物。 右图是初始反应速度常数的定量分析。(b)SMARCAD1结合hexasome的整体冷冻电镜结构。虚线框中的HBD(c)区域和CTH区域(d)进一步放大展示。(e)mESC在不同条件下的细胞形态,以及碱性磷酸酶染色。Con:未处理。KD:敲低内源Smarcad1表达量。EV:回补空载。WT:回补野生型Smarcad1。D821K:回补HBD 突变(D821K)的Smarcad1。ΔCTH:回补ΔCTH突变的Smarcad1。
为了回答SMARCAD1为何丧失对经典核小体重塑活性这一问题,研究者进一步解析了SMARCAD1结合核小体的复合物结构,发现SMARCAD1虽然可以结合经典核小体,但结合方式松散,是一种没有活性的结合模式(图2)。研究者根据结构推断,如果SMARCAD1以经典构象结合核小体,其HBD将与核小体的组蛋白表面产生空间冲突。这解释了SMARCAD1丧失对经典核小体重塑活性的结构性内因。
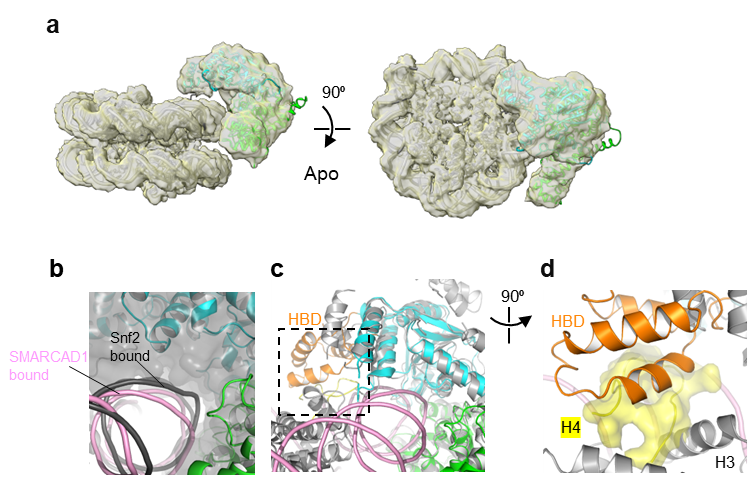
图2 SMARCAD1结合经典核小体的冷冻电镜结构。(a)SMARCAD1结合核小体的apo状态冷冻电镜结构。(b)核小体DNA在Snf2(表面模型)与SMARCAD1(卡通模型)结合时的构象对比。SMARCAD1不能紧密结合核小体,两者之间有明显空隙。(c-d)假设以经典模式结合核小体,SMARCAD1将与核小体的组蛋白发生空间排斥。(c)的虚线框中的区域被旋转,放大展示在(d)。
值得一提的是,广泛参与核小体拆分与重新组装的组蛋白分子伴侣FACT复合物与SMARCAD1产生协同效应(图3a)。FACT可能通过部分拆分核小体,极大促进SMARCAD1对核小体的染色质重塑活性。这一发现进一步加强了SMARCAD1在调控亚核小体动态的作用模式(图3c)。SMARCAD1独特的亚核小体重塑活性为研究细胞内的亚核小体打开了一个窗口,提示亚核小体可能是稳定的功能单元,而非传统认知的短暂副产物。与SMARCAD1功能相符,DNA损伤修复时,组蛋白发生多种修饰,这些修饰抑制完整核小体组装,却促进亚核小体稳定化。此外,细胞快速复制时,如早期胚胎细胞分裂,核小体高效拆分-重组,可能导致亚核小体大量累积。这些染色质发生迅速变化的生命活动为研究亚核小体以及亚核小体调控蛋白提供广阔的舞台。
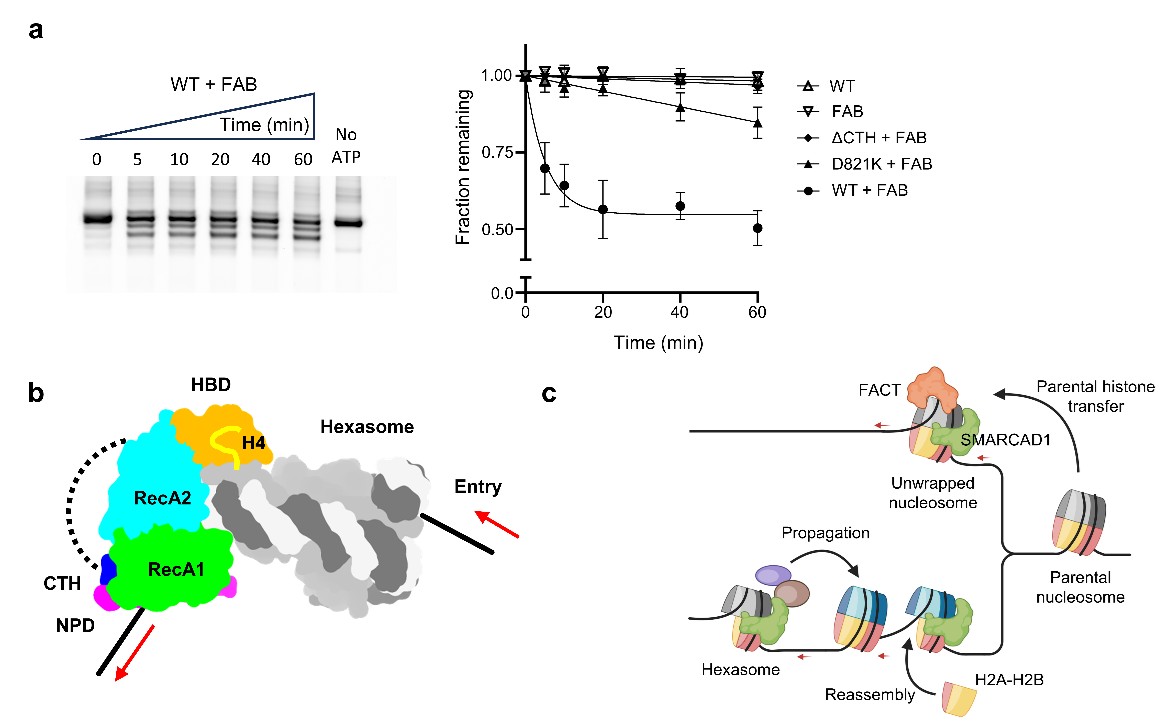
图3 SMARCAD1-FACT相互作用及功能协同。(a)SMARCAD1与FACT协同重塑核小体。右图是核小体滑移的动力学跟踪分析。WT:野生型SMARCAD1全长蛋白;D821K:具有D821K突变的SMARCAD1;ΔCTH:将CTH截短的SMARCAD1蛋白;FAB:FACT与H2A-H2B 二聚体混合物。(b)SMARCAD1滑移hexasome的卡通模式图。(c)SMARCAD1在复制叉区域发挥功能的可能模式:帮助亲代组蛋白转移到子代;推动复制后抑制性组蛋白修饰扩散,以及滑离过于靠近的亚核小体与核小体,帮助重新组装染色质。
清华大学生命科学学院/北京生物结构前沿研究中心陈柱成教授、郗乔然副教授为本文的通讯作者。清华大学生命科学学院、清华-北大生命科学联合中心2018级博士生胡鹏晶、2023级博士生孙菁溪、博士后孙宏瑶和博士后陈康净为本文共同第一作者,2020级博士生谢悠扬和夏显(已毕业)参与了重要工作。本工作获得国家自然科学基金、科技部重大科学研究计划专项、北京生物结构前沿研究中心、清华-北大生命科学联合中心、国家蛋白质科学研究(北京)设施清华基地的大力支持。