乙型肝炎病毒(HBV)感染是全球范围内严重的公共卫生挑战。长期感染可引发慢性肝炎、肝纤维化、肝硬化,最终导致肝细胞癌(HCC)。HBV侵染宿主细胞后,其基因组进入细胞核并转化为共价闭合环状DNA(cccDNA),以微染色体形式长期稳定存在。通常情况下,在宿主细胞多种因子的调控下,cccDNA处于转录沉默的异染色质状态。然而,HBV编码的调控蛋白HBx可通过招募表观遗传调控因子,解除转录抑制并激活cccDNA,从而推动病毒复制和感染进程。近期研究表明,HBx通过劫持表观调控因子Spindlin1,解除cccDNA的异染色质屏障,促进HBV的转录。但是,目前关于HBx调控HBV转录的表观遗传重塑机制仍不清楚。
2025年3月7日,清华大学基础医学院/北京生物结构前沿研究中心李海涛课题组在Protein & Cell杂志上在线发表题为“Unfolding HBx for an epigenetic switch of HBV cccDNA minichromosome”的展望文章,提出了HBx通过招募HDAC1, HP1或DNMT3A等共沉默因子或Spindlin1, Bcl-2或DDB1等共激活因子实现其双态构象切换,进而调控HBV cccDNA转录的表观遗传重塑机制。

本文首先概述了HBx蛋白C端和N端结构域在HBV复制与转录调控中的不同功能。HBx的C端结构域通过与DDB1、Bcl-2等多种宿主蛋白互作,促进HBV的转录和复制。而N端结构域则可通过结合XAP2、Prdx1等宿主蛋白,发挥反式抑制功能,从而限制HBx的转录激活。
随后,本文系统总结了HBV cccDNA转录的表观遗传调控网络。宿主细胞利用DNMTs、SETDB1和HDACs等表观因子沉默cccDNA,限制病毒基因的表达。HBV则通过HBx拮抗这些宿主抑制因子的作用,招募CBP/p300、PCAF和LSD1等,重塑cccDNA染色质结构,使其处于转录活跃状态。
最后,该文章重点阐述了HBx在HBV转录调控中的构象转换及其双重功能机制。HBx的N端序列能够特异性招募组蛋白甲基化“阅读器”Spindlin1,解除其转录抑制作用,促进HBV转录。结合前期研究的结构基础和AlphaFold预测,发现HBx在与Spindlin1结合后发生构象改变,使原本包裹在疏水核心中的DDB1和Bcl-2结合位点暴露,从而促进共激活因子的招募,推动cccDNA从异染色质状态向活跃染色质状态的转换。基于此,本文提出HBx存在两种功能状态:在折叠构象下,HBx可招募HDAC1、DNMT3A和SETDB1等共抑制因子,维持cccDNA的转录沉默;而在伸展构象下,HBx通过招募Spindlin1、DDB1和Bcl-2等因子,促进cccDNA开放并激活HBV转录。
综上,该文强调了HBx蛋白的构象转换及其与Spindlin1的相互作用在HBV基因组表观遗传重编程过程中的关键作用,为HBV转录调控及其潜在治疗策略提供了新的见解。此外,Spindlin1介导的多价态组蛋白甲基化修饰识别机制可能通过与病毒编码蛋白的协同作用,广泛参与病毒的表观遗传调控。这一发现揭示了病毒-宿主互作中的关键表观遗传机制,还提示针对该通路的干预策略或可拓展至其他病毒感染相关疾病领域。
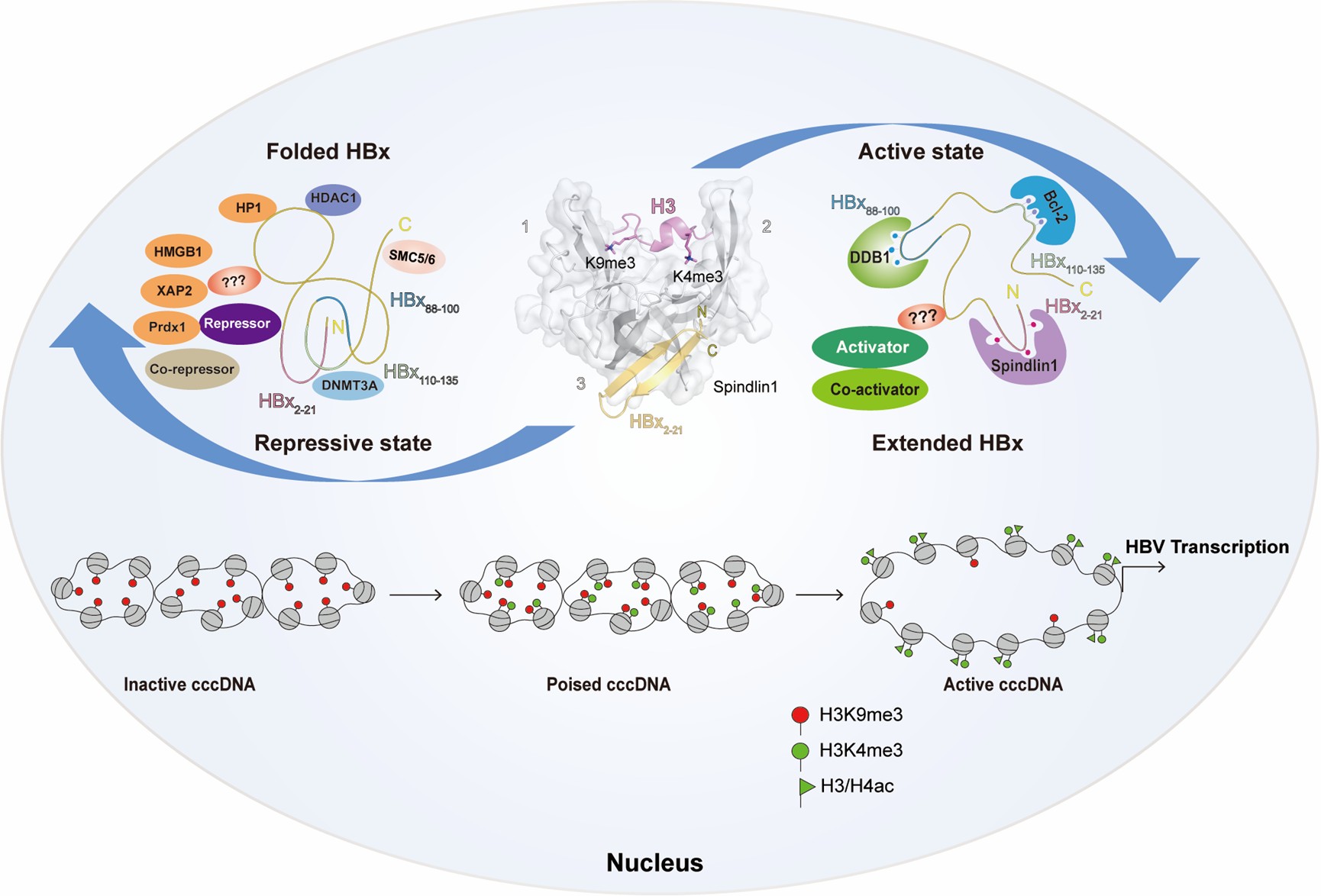
Spindlin1介导HBx构象转换调控HBV cccDNA表观重编程的示意图
清华大学基础医学院已出站博士后刘伟和医学实验班2020级学生张秀岚为本文的共同第一作者。清华大学基础医学院/北京生物结构前沿研究中心李海涛教授为本文的通讯作者。清华大学基础医学院王大亮教授和医学实验班2017级学生邓雅方共同参与撰写。本研究得到了国家自然科学基金项目、国家重点研发计划项目、北京市自然科学基金项目、山西医科大学-清华大学医学院前沿医学协同创新中心、清华-北大生命科学联合中心、分子肿瘤学全国重点实验室、北京生物结构前沿研究中心的大力支持。
值得一提的是,近日,康奈尔大学的Yael David和Robert E. Schwartz与洛克菲勒大学的Viviana I. Risca联合在Cell期刊上发表了题为“A nucleosome switch primes hepatitis B virus infection” 的研究论文。该研究通过建立体外重组cccDNA平台,揭示了cccDNA中核小体开关的状态对X基因转录的调控作用,明确了cccDNA染色质化与X基因转录之间的直接关联,也强调了染色质(核小体)状态对乙肝病毒感染的调控作用(详见BioArt今日单独解读报道)。