核孔复合物(nuclear pore complex, NPC)是真核细胞的核膜上负责物质双向运输的唯一通道,同时也是真核细胞中最庞大,最复杂的分子机器之一。核孔复合物在维持细胞核的微环境稳态,保护遗传物质,调控基因表达等方面起着至关重要的作用,其功能异常与包括癌症在内的多种疾病的发生联系在一起。NPC的高分辨率结构研究对理解真核细胞活动的基本过程,探究核质运输的结构机制以及探索相关疾病的致病机理都具有重要意义,也是开发相应治疗方法和药物的基础。
NPC镶嵌于细胞核的双层核膜(nuclear envelope, NE)之上,在从细胞质到细胞核的方向上,主要由胞质丝(cytoplasmic filaments)、胞质环(cytoplasmic ring, CR),内环(inner ring, IR)、腔环(Luminal ring, LR)、核质环(nuclear ring, NR)和核篮(nuclear basket)组成(图1)。其中,CR、IR和NR构成NPC最稳定的支架部分,其直径可达约110 nm,高约70 nm。而附着于CR上的胞质丝、附着于NR上的核篮以及主要由IR中的FG重复(FG repeats)构成的扩散屏障(diffusion barrier)则是NPC选择性运输的主要执行者。此外,在垂直于NE的方向上,NPC还具有C8对称性。一个NPC含有约30种不同的核孔蛋白(nucleoporin),每种核孔蛋白的拷贝数一般为八的倍数,因此一个NPC含有的核孔蛋白数目非常大(500-1000个)。这也导致NPC具有非常大的分子量,在酿酒酵母中约为60 MDa,而在人中则可达约110 MDa。

图1:NPC的结构示意图
2022年6月10日,清华大学结构生物学高精尖创新中心施一公团队在Science上在线发表了题为 Structure of the cytoplasmic ring of the Xenopus laevis nuclear pore complex 的最新研究成果,报道了目前分辨率最高的,NPC中CR亚基的结构。

该研究以非洲爪蟾(Xenopus laevis)NPC为研究对象,单颗粒冷冻电镜分析为主要研究手段。团队共收集46143张电镜照片,从中人工筛选出33747张可用照片,并进一步挑选出800825个NPC颗粒用于数据处理。经过多轮迭代计算,该团队最终将NPC中CR亚基重构至3.7-4.7 Å分辨率。同时,该研究还利用重组表达技术和单颗粒冷冻电镜分析手段,将脊椎动物中特有的核孔蛋白Nup358的N端结构域解析至3.0 Å分辨率。以这些重构结果为基础,该团队最终搭建了迄今为止最完整的CR结构模型(图2)。
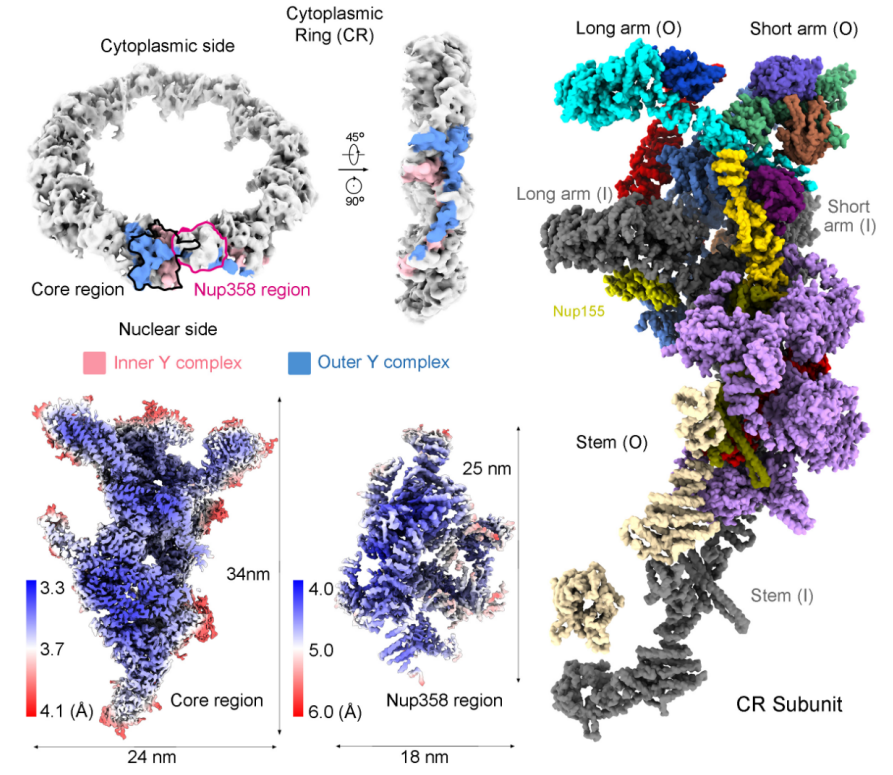
图2:CR亚基的单颗粒冷冻电镜结构
该模型中CR亚基的主体由两个Y复合物组成,此外还包含五个Nup358、两个Nup205和两个Nup93分子。在Y复合物中,新解析的Nup160的C端片段作为组织中心,在介导三条臂汇集上起着重要作用。而Nup358、Nup205和Nup93在辅助以及稳定CR骨架的组装过程中起着重要的作用。
结合施一公团队之前解析的NR和IR高分辨结构,他们搭建了NPC支架部分的结构模型。该模型包含了来自632个核孔蛋白中的约445000个氨基酸残基,是目前为止最详细,且最精确的NPC支架结构模型(图3),为领域内理解脊椎动物NPC的组成、结构、组装以及功能提供了坚实的基础。
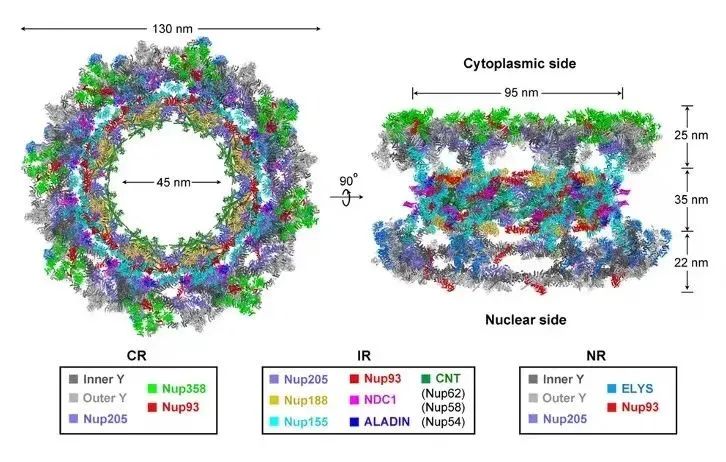
图3. NPC支架的结构模型
西湖大学生命科学学院博士后朱薛辰、黄高兴宇、曾超、占谢超和三年级博士生梁珂为该文共同第一作者,黄高兴宇和清华大学结构生物学高精尖创新中心施一公教授为该文共同通讯作者。
原文链接:
参考文献:
1. The structure of the nuclear pore complex (an update). Annu. Rev. Biochem. 88, 725–783 (2019). doi: 10.1146/annurev-biochem-062917-011901.
2. Cryo-EM structure of the inner ring from the Xenopus laevis nuclear pore complex. Cell Res. 32, 451–460 (2022). doi: 10.1038/s41422-022-00633-x.
3. Cryo-EM structure of the nuclear ring from Xenopus laevis nuclear pore complex. Cell Res. 32, 349–358 (2022). doi: 10.1038/s41422-021-00610-w.