2022年2月10日,清华大学生命科学学院、结构生物学高精尖创新中心、北京生物结构创新中心、清华-北大生命科学联合中心杨茂君教授研究团队在Nature Structural & Molecular Biology杂志发表题为The coupling mechanism of mammalian mitochondrial complex I(哺乳动物线粒体复合物I偶联催化反应机理)的研究论文,报道了哺乳动物线粒体复合物I不同催化状态及鱼藤酮抑制状态超高分辨率结构(最高分辨率达2.38埃),通过对解析的68个不同状态结构(下图)的分析比对,全面而系统的阐释了线粒体复合物I偶联氧化还原反应与质子转运的全新分子机理。

此前杨茂君教授研究组分别在Nature (2012, 2016)、Cell (2016, 2017)和Science (2019)杂志发表研究长文【1-5】,详细阐释了酵母来源的II型复合物I晶体结构、猪源及人源哺乳动物呼吸链超级复合物I1III2IV1的原子分辨率三维结构,人源呼吸链巨型复合物I2III2IV2中等分辨率结构,以及猪源ATP合酶四聚体高分辨率结构。本篇复合物I催化机理的研究论文是杨教授研究组在线粒体氧化磷酸化系统研究领域又一项重要进展。
复合物I(NADH:泛醌氧化还原酶)是细胞内最大的膜蛋白复合物之一,也是呼吸链中构成最为复杂的多亚基复合物,且越高等生物的复合物I的构成越复杂。复合物I包含14个从原核生物到高等哺乳动物都非常保守的核心亚基,这些亚基相互作用排列呈L形。分布在线粒体基质一侧的7个亲水核心亚基由细胞核基因编码,行使NADH脱氢酶的功能,一次催化反应中可以从NADH获得2个电子,通过由1个FMN和7个铁硫簇组成的电子传递载体链传递给辅酶Q将其还原为QH2。另外7个核心亚基为跨膜疏水亚基,在真核生物中由线粒体基因组编码,包含4个与反向转运体结构类似的质子泵,一次催化反应中可以偶联辅酶Q氧化还原反应释放的能量转运4个质子到线粒体膜间隙,使得线粒体内膜两侧形成质子浓度梯度用于驱动ATP合酶合成ATP及热量。除了这14个核心亚基,哺乳动物复合物I还包含31个附属亚基,用于复合物I的组装、稳定以及活性调节。在哺乳动物线粒体中大约有90%的复合物I以超级复合物的形式存在(其它约10%可能是未完全组装的复合物I)。
复合物I 作为电子进入呼吸链的起始点,在整个氧化磷酸化反应过程中发挥着至关重要的作用,其功能障碍会引起细胞呼吸作用至少40%的衰减,进而导致多种疾病,诸如阿尔茨海默病、帕金森病、多发性硬化症、肌萎缩性脊髓侧索硬化症、嗜酸细胞型腺瘤、遗传性视神经病变、婴儿致死性线粒体病、Leigh综合征、糖尿病以及肥厚型心肌病等。因此线粒体复合物I的结构与催化机理研究显得尤为重要。由于线粒体复合物I的构成复杂,关于其工作机理一直没有非常准确的理论。目前比较被大家认可的工作模型是“单Q”模型,即复合物I在一次催化反应中结合/解离一个辅酶Q分子,其还原产生的QH2需要和溶解在线粒体内膜的氧化型辅酶Q进行交换以完成下一次催化。而复合物I中靠近N2铁硫簇的辅酶Q结合位点被认为是偶联氧化还原反应与质子转运的位点,但从来没有研究组观察到该位点结合内源辅酶Q的结构【6-8】。
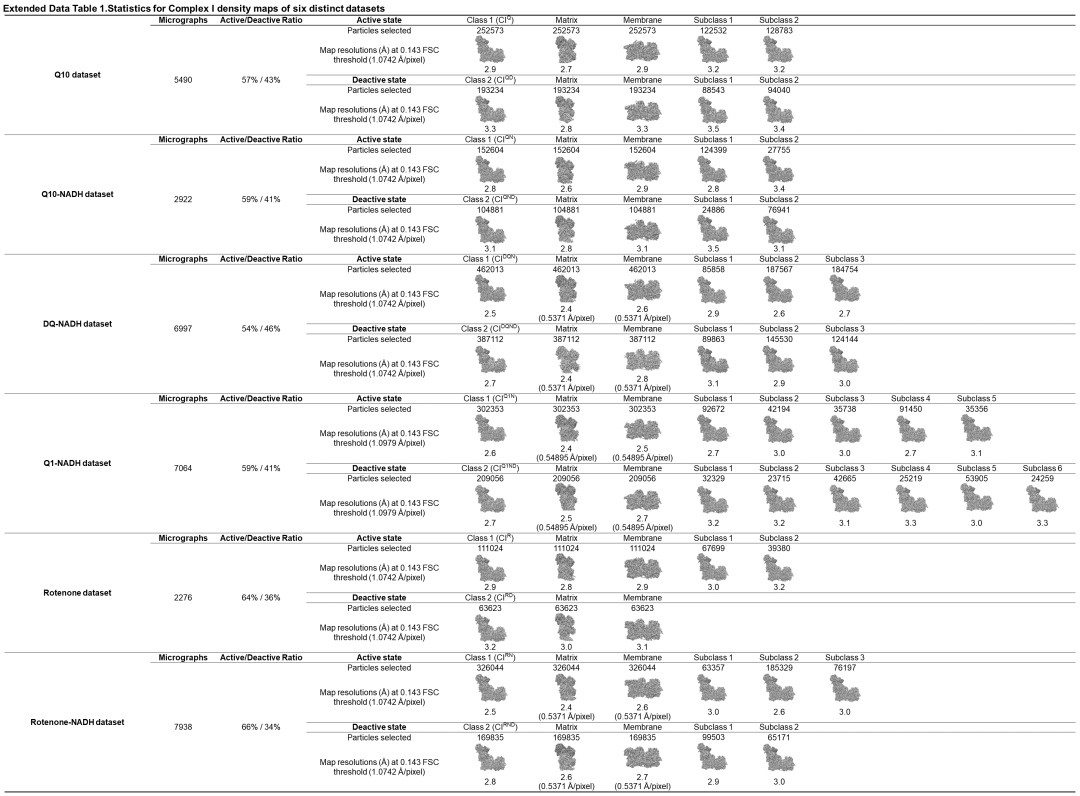
在此次发表的研究论文中,杨教授研究组解析了复合物I与内源辅酶Q10、复合物I与Q10-NADH、复合物I与DQ-NADH、复合物I与Q1-NADH、复合物I与经典抑制剂鱼藤酮,以及复合物I与鱼藤酮-NADH这六种结构,最高分辨率高达2.38埃,在复合物I中尤其是其跨膜区内部鉴定到大量的水分子参与质子的转运。通过对结构的分析发现,哺乳动物复合物I主要存在“活性”和“失活”两种构象状态。因为采用了温和的蛋白纯化方法,不仅首次观察到了内源辅酶Q10位于靠近N2铁硫簇位点的复合物I的结构,并且“活性”构象状态的复合物I占比高达57%-66%,远高于其他课题组的0%-12%。而后进一步分析发现,失活态不具有参与催化反应的结构基础,是一种所谓的休眠状态;只有活性态复合物I参与到催化反应中的,且极其微小的构象变化就可以完成对辅酶Q10的还原,保证了复合物I可以以400次/秒的催化速率进行反应。该发现否定了之前其他研究组认为的复合物I催化是通过“活性”和“失活”两种构象状态的结构转换来实现的【7】。
研究人员发现在复合物I的辅酶Q反应腔中始终结合着一个不解离的辅酶Q10分子,并在其内部鉴定到了四个辅酶Q10结合位点,分别是:位点1、位点1F、位点2和位点3。位点1是辅酶Q10被还原的位点;位点1F可以结合一个翻转的、短链的辅酶Q1,同样也具有结合辅酶Q10的能力;位点2包含大量的极性氨基酸,可以结合氧化态或还原态的辅酶Q10;位点3靠近辅酶Q反应腔出口位置,只在失活态的复合物I中可以观察到。此外,还在活性态复合物I 的NDUFA9亚基C端结构域发现了一个辅酶Q10的结合位点,该位点可以“感知”分布在线粒体内膜中辅酶Q10的多少,并可以通过一个新鉴定的、位于复合物I内部的氢键网络来影响和调节复合物I的活性状态进而影响线粒体的能量代谢过程。
研究人员还发现发生在位点1的辅酶Q10的还原反应并不能引起复合物I跨膜区的构象变化,位点1不是像之前大家认为的是复合物I偶联氧化还原反应与质子转运的位点;含大量的极性氨基酸的位点2才是最有可能的将氧化还原反应与质子转运相偶联的位点。活性态的复合物I在发挥催化功能时需要两个辅酶Q10相互协同来发挥功能,具体工作机理详见图1。该研究工作揭示了线粒体复合物I全新催化机理,颠覆了人们对高等生物复合物I催化机理的认知,为复合物I的功能研究提供了详实的结构实验数据支持,并为靶向复合物I的小分子药物设计提供了实验基础和新的思路。
杨茂君教授研究组长期致力于线粒体呼吸链蛋白的结构与功能研究以及相关靶向药物的开发,此前在Nature(2012)、PCCP(2017)和JMC(2017)等杂志连续报道了II型线粒体复合物I(NDH-2)的详细电子传递机制,同时开发了以疟原虫NDH-2为靶标的针对耐药性疟原虫的新型抗疟疾药物前体分子,为开发新的治疗疟疾的药物打下了良好的基础。杨茂君教授研究团队将再接再厉对线粒体氧化磷酸化系统进行更加深入的研究,并将致力于研发治疗线粒体异常疾病的新型靶向药物。
清华大学生命科学学院谷金科(博士后,现为深圳大学医学部特聘教授)、刘天涯(16级博士生)、郭润域(结构生物学高精尖创新中心卓越学者、清华大学水木学者)、张来幸(博士后)是此篇论文的共同第一作者。
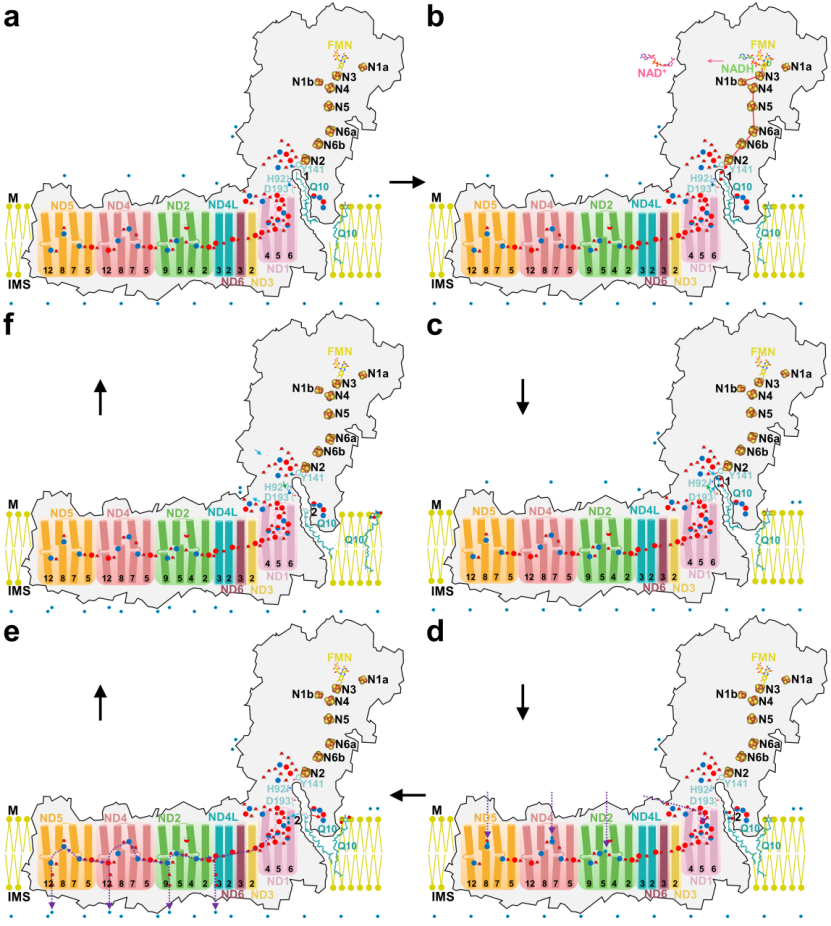
图1 复合物I催化机理示意图
原文链接: